кривая растворимости, характеризующая равновесие концентрированного
Автоматизация процесса кристаллизации
Система с резким возрастанием растворимости.
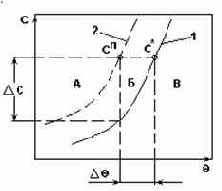
Рис.1.
1 - c*=f(q) - кривая растворимости, характеризующая равновесие концентрированного раствора при изменении q.
2 - сп= f(q) - линия условной границы метастабильной области.
А - неустойчивая, лабильная область массового образования центров кристаллизации;
Б - относительно устойчивая метастабильная область образования и растворения кристаллов;
В - область ненасыщенных растворов.
Система с плавным изменением растворимости.
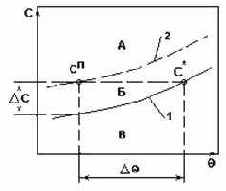
Рис.2.
- Переход в область пересыщенных растворов происходит только при значительном охлаждении.
- При этом выделяется незначительное количество твердой фазы.
- Рекомендуемый способ кристаллизации - получение сп удалением части растворителя из раствора.
- Рекомендуемый метод кристаллизации - вакуум-кристаллизация.
Система с незначительным изменением
растворимости.
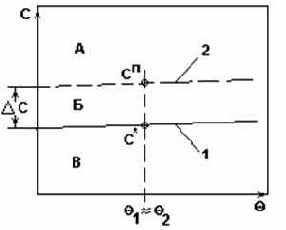
Рис.3.
- Рекомендуемый способ кристаллизации - получение сп путем выпаривания растворителя из раствора.
- Рекомендуемый метод кристаллизации - изотермическая кристаллизация.
- Изотермическая кристаллизация - это кристаллизация с удалением части растворителя испарением или вымораживанием.
растворимости.
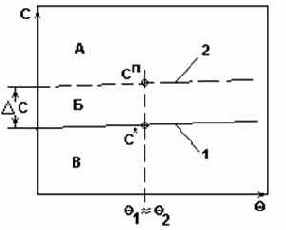
Рис.3.
- Рекомендуемый способ кристаллизации - получение сп путем выпаривания растворителя из раствора.
- Рекомендуемый метод кристаллизации - изотермическая кристаллизация.
- Изотермическая кристаллизация - это кристаллизация с удалением части растворителя испарением или вымораживанием.
Кинетика процесса кристаллизации.
Скорость образования центров кристаллизации:

где


КN, КN0 - константы,

EN - энергия активации зародышеобразования, (кдж/кг);
Сп и С* - концентрации пересыщенного и насыщенного растворов, (кг/м3);
m=2 - 4 - кинетический коэффициент, зависящий от типа кристаллизующегося вещества.
Качественная характеристика скорости роста кристаллов.
Зависимости скорости кристаллизации от времени.
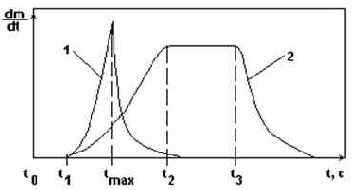
Рис.4.
1 -

2 -


t0 - t1 - индукционный период, т.е. период подвижного равновесия зародышей с раствором.
Кривая 1 - при большой степени пересыщения имеет резкий максимум скорости процесса в момент tmax.
Кривая 2 - при малой степени пересыщения имеет пологий максимум в течение времени t2 - t3.
Количественные оценки скорости роста кристаллов на основании диффузионной теории.
- Процесс встраивания молекул в кристаллы идет с большой скоростью и кинетика процесса определяется скоростью подвода вещества к поверхности кристалла:

где
b - коэффициент массоотдачи, кг/м2*с;
Сп-С*=D, (кг/кг);
F - поверхность кристалла, (м2).
Для аппаратов с мешалками коэффициент массоотдачи b зависит от следующих параметров:

где
а - характеристический размер кристалла;
n - число оборотов мешалки, об/мин;
dм - диаметр мешалки, м.
- Процесс подвода вещества к поверхности кристалла идет с большой скоростью. Кинетика процесса определяется скоростью встраивания молекул в кристалл:

где
КB - константа скорости встраивания молекул в кристалл;
n - эмпирическая постоянная.
- Оба процесса протекают с соизмеримыми скоростями:

где
К - общий коэффициент скорости процесса, определяемый из соотношения:

Учитывая, что К=f(b, KB), а b=f(n), в целом можно считать:

Таким образом, скорость роста кристаллов определяется поверхностью кристалла, движущей силой процесса и скоростью мешалки.
Объект управления
Изогидрический кристаллизатор непрерывного действия с мешалкой.
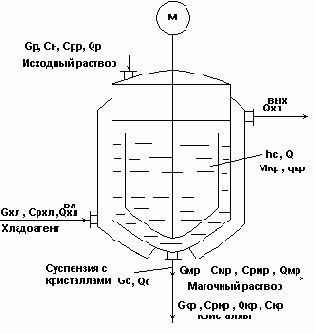
Рис.5.
В схеме принято:
Gс=Gмр+Gкр; qмр = qкр = qс =q;
Скр = 1, т.е. кристаллы чистые.
Работа объекта
Исходный горячий насыщенный раствор подается сверху в аппарат, где охлаждается с помощью хладоносителя, подаваемого в рубашку и становится пересыщенным.
В результате пересыщения раствора и при интенсивном перемешивании происходит кристаллизация целевого компонента из раствора с образованием кристаллов (Мкр®Gкр).
При этом концентрация раствора понижается и оставшаяся жидкая фаза Gмр в смеси с Gкр в виде потока суспензии Gc выводится из процесса.
Показатель эффективности процесса - диаметр кристаллов, dкр.
Цель управления процессом - обеспечение dкр = dкрзд.
Материальный баланс по всему веществу
Уравнение динамики:

Уравнение статики при


Материальный баланс по кристаллизуемому веществу.
Уравнение динамики:

Уравнение статики при


- В уравнение (4) подставим выражение из (2) и полагаем Скр=1:


- Из (5) выразим Gкр в явном виде:

- Выражение (6) представляет Gкр на основе материального баланса процесса кристаллизации.
- Но , которое определяется на основе физики процесса массопередачи:


где

за время tпр в объеме Vс;

- Так как и
 , а также
, а также , то на основе физики массопередачи можно считать:
, то на основе физики массопередачи можно считать:

- В целом, на основании (6) и (7) можно записать:

Математическое описание для размера частиц.
- На основании диффузионной теории и правила Мак- Бена скорость роста кристаллов можно представить через радиус частиц:

где

r - радиус кристалла, м; t - время, с;
К, К0 - константы,

Сп, С* - концентрации пересыщенного и насыщенного растворов, кг/м3;
Еа - энергия активации, кдж/кг;
q - температура, К;
R - универсальная газовая постоянная, кдж/кг*К.
- На основании (9) и (10) - диаметр кристалла можно представить:

- Если процесс кристаллизации вести при q = const = qзд и обеспечить Сн= const, то Сп и С* будут предопределены, т.к. система имеет 2 степени свободы (s=2).
- Таким образом, dкр=dкрзд можно обеспечить стабилизацией q при условии Сн= const.
Уравнение динамики:

Можно принять q = qмр = qкр = qс .
Уравнение статики при


- На основании (11) и (12) можно считать:

- Предпочтительное управляющее воздействие Gхл .
Информационная схема кристаллизатора
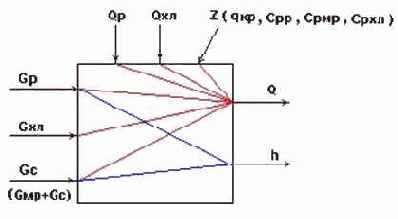
Рис.6.
- Основные регулируемые переменные: ;

- Возможные регулирующие воздействия:

- Возможные контролируемые возмущения:

- Возможные неконтролируемые возмущения:

- В целом, кристаллизатор является сложным многосвязным объектом.
Типовая схема автоматизации процесса кристаллизации
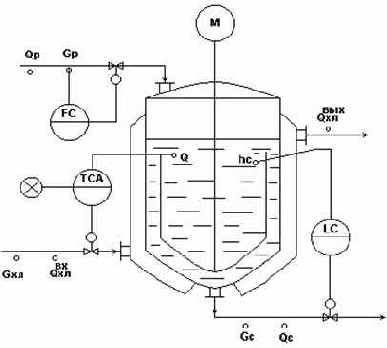
Рис.7.
1. Регулирование.
- Регулирование q в аппарате по подаче хладоагента Gхл - обеспечивает косвенное регулирование показателя эффективности процесса: q= f (dкр).
- Регулирование h по отбору маточного раствора Gмр - для обеспечения материального баланса по жидкой фазе.
- Стабилизация расхода исходного раствора Gр - для обеспечения заданной производительности установки.
- Расходы: .

- Температуры: .

- Уровень: h.
- Значительные отклонения температуры q от задания.
